|
Molecular Pathology of Cancer
|
|
癌の分子病理学
|
|
―病理診断と遺伝子診断の接点―
|
文・安井 弥
(Yasui, Wataru)
大学院医歯薬学総合研究科
探索医科学講座
(腫瘍分子病理学)教授
|
病理診断(病変部の組織の一部を採って顕微鏡で観察し細胞や構造の異常に基づいて行う診断)は、癌医療の中でとても重要な役割を担っています。同じ組織の一部において、遺伝子・分子情報を分子病理学的に解析する遺伝子診断により、遺伝性や悪性度に加えて、発癌感受性(癌になり易いかどうか)もわかるようになってきました。
|
●病理診断の重要性とその弱点
胃カメラを飲んだ時、内視鏡をしたお医者さんは「少し気になるところがありましたので、小さな組織を採り検査に出すことにしました。結果は一週間後に出ます。」というかもしれません。実は、この「検査に出す」というのは間違いで、採取した組織片(組織検体)についての病理診断を病理医に依頼することなのです。大きな病院では、病理医が常勤し、生検や手術例の診断に当っています。受け取った組織は、切片化され、染色を加えてスライドグラスにのった組織標本となります(図1)。これを病理医が顕微鏡で観察し、細胞の形や組織の構造の乱れなどに基づいて診断するのが病理診断です。手術中は、迅速に(十分程度)診断し、手術方針の決定に深く関与します。最終診断という決定的な役割を担っているのです。しかし、細胞や組織の形態異常に依存した病理診断には、いくつかの点で限界が存在するのも事実です。例えば、良性と癌の中間的な形態を示す場合(境界領域病変)がありますし、癌の生物学的な悪性度や予後の類推にも限界があり、遺伝性腫瘍かどうかもわかりません。
 図1 生検でみられた胃の分化型癌の組織像
図1 生検でみられた胃の分化型癌の組織像
|
●癌の発生・進展の分子機構
病理学は、病気がどのような機序によって発生し進展していくかを総合的に解明する学問です。そして、病理学は、形態観察に基づいた病理診断を実践すると共に、分子生物学、遺伝子工学等の考え方と手法を導入して病気の本態を究明する「分子病理学」という分野を確立しました。新知見の病態における普遍性を検証することとそれがいかに形態の異常に反映されるかを明らかにすることが最大の使命です。癌は、多段階的に遺伝子異常(変異や欠失など)とエピジェネティックな異常(遺伝子自体に異常はないがmRNAに転写される段階や蛋白に翻訳された後の異常)が蓄積して発生・進展していくことが知られています。私達をはじめとする分子病理学的解析の結果、消化管癌では、遺伝子不安定性(DNA複製時のエラーが修復されず遺伝子の異常が蓄積しやすい状態)、細胞増殖・細胞周期、細胞接着、不死化(細胞が永遠に生き続けること)、細胞外基質分解などに関連した様々な遺伝子・分子の異常が密接に関わることが明らかになっています(図2)。遺伝子の発現を調節する領域のCpG部位(DNAを構成する四種類の塩基の内シトシンとグアニンに富む部分)のメチル化とその領域に存在する中心的な蛋白質ヒストンの脱アセチル化による種々の癌抑制遺伝子の発現抑制は、癌化のごく早期から見られるエピジェネティックな異常の代表です。
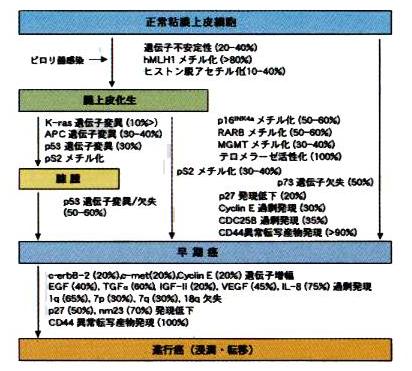
図2 胃の分化型癌の発生・進展過程における遺伝子・分子の異常
|
●組織検体における遺伝子診断
このように、癌の発生・進展過程における異常の種類と起こる順序が分かると、その異常は、癌であるかどうかや癌細胞が転移する能力が高いかどうかを知るための客観的な診断の指標となります。したがって、これらの解析を組織検体について行うことにより、良性病変との客観的鑑別診断や遺伝性腫瘍のキャリアーの同定・発症前診断、癌の悪性度診断などが可能となります。私達は、広島市医師会臨床検査センターと共同で、消化管の病理組織検体に対する遺伝子診断(分子病理診断)を導入し、七年間に一万症例以上を解析してきました。例えば、悪性度診断では、食道癌で三十一%、胃癌で十二%を特に悪性度の高い癌と診断しましたが、これらは確かに手術後の生存率が低い傾向を示しています。重複癌(別の臓器に発生した二つ以上の癌)や多発癌(同じ臓器に発生した二つ以上の癌)では遺伝子不安定性を示す傾向の強いことが分かっています。私達の遺伝子診断では、遺伝子不安定性が同定された胃癌症例の半数において、臨床的に同時性あるいは異時性に重複癌や多発癌が見つかりました(図3)。
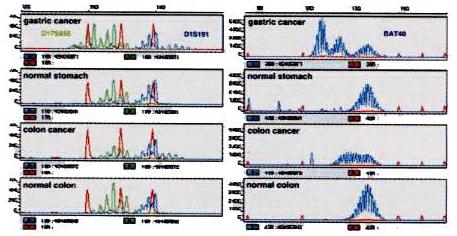
図3 胃と大腸の重複癌症例にみられた遺伝子不安定性
(クリックすると拡大します)
|
●これからの遺伝子診断
ヒトゲノムの全塩基配列を解明することが最大の命題であった時代から、ゲノムに存在する全遺伝子を同定しその構造や機能および病態との相関を網羅的に解析するポストシークエンス時代に入りつつある今、遺伝子診断も時代に対応して進化しようとしています。体系的・網羅的に遺伝子解析を行うDNAマイクロアレイ(スライドグラス程度の基盤に目的とする遺伝子に相補的な配列のDNAを高密度に定着し同時に何千個の遺伝子を解析する方法)をはじめとする先進技術は、その大きな推進力になっています。「分子病理学」では、膨大なゲノム情報を背景に、蛋白の機能に留まらず、形態までも包括する形態的ゲノム研究(morphological genomics)を展開し、遺伝子・分子の異常に裏打ちされた形態変化を詳細に理解することが必要です。図4には、生検組織についての新しい遺伝子診断のストラテジーを示しました。まず検体から、レーザーマイクロダイセクション(顕微鏡下に目的とする部位にレーザーを当てることにより細胞数個の単位で試料を採取する方法)を併用して正確にDNAあるいはRNAを抽出します。遺伝子発現解析では、それぞれの臓器に特異的な数百程度の遺伝子解析用マイクロアレイを用いて、浸潤・転移の能力や薬剤感受性に関する癌の個性診断を行います。前癌性病変や境界領域病変を同様に解析すると、「真の前癌性病変」(必ず癌に進行していく病変)が同定できます。正常組織におけるSNP(single nucleotide polymorphism:一つの塩基の違いのことで、遺伝子の機能や発現量が変わることがある)をSNP用ミニアレイで解析すると、発癌感受性、薬剤感受性、遺伝性腫瘍の同定などが可能になります。間もなく、病理診断室から、薬物療法や疾患の予防に関する情報を発信することができるでしょう。
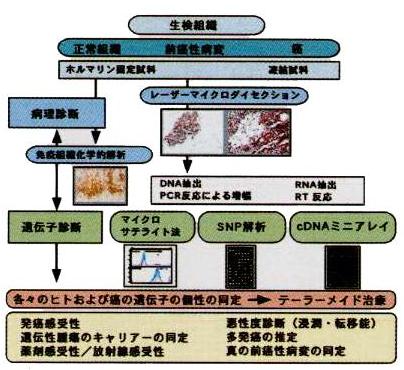
図4 病理検体に対する新しい遺伝子診断ストラテジー
|
プロフィール
- 1986年広島大学大学院医学系研究科病理系専攻修了(医学博士)
- 1987年米国スクリップスクリニック研究所研究員(生化学部門)
- 1992年広島大学助教授(医学部第一病理)
- 2000年同教授( 〃 )
- 2002年同大学院教授(医歯薬学総合研究科探索医科学)
- 専門分野:分子病理学、消化管腫瘍、遺伝子診断
- URL:
http://home.hiroshima-u.ac.jp/byori1/
|
 |
広大フォーラム33期6号 目次に戻る
 図1 生検でみられた胃の分化型癌の組織像
図1 生検でみられた胃の分化型癌の組織像
 図1 生検でみられた胃の分化型癌の組織像
図1 生検でみられた胃の分化型癌の組織像



